الموضوع : درس الروابط الكيميائية ( التناسقية ، الهيدروجينية ، الفلزية وقوى فان درفال ) .
الأهداف التعليمية
يتوقع من الطالب في نهاية الدرس أن :
1- يعرّف الرابطة التساهمية التناسقية .
2- يميّز بين الرابطة التساهمية العادية والرابطة التساهمية التناسقية
3- يمثّل للرابطة التساهمية التناسقية .
4- يوضّح مفهوم الرابطة الهيدروجينية .
5- يمثّل للرابطة الهيدروجينية .
6- يوضح أثر الرابطة الهيدروجينية على درجات غليان وانصهار المواد .
7- يعلّل ارتفاع درجة غليان الماء مقارنةً بمركبات عناصر المجموعة السادسة مع الهيدروجين .
8- يشرح مفهوم الرابطة الفلزية .
9- يفسّر سبب توصيل الفلزات الجيد للحرارة والكهرباء .
10- يذكر ماهية روابط ( قوى ) فان درفال .
11- يمثّل لروابط فان درفال .
الرابطة التناسقية CO-ORDINATE (DATIVE COVALENT) BONDING
عبارة عن رابطة تساهمية تساهم فيها إحدى الذرتين بالزوج الالكتروني الرابط بينما يقتصر دور الذرة الأخرى على المساهمة بمجال فارغ .
مثال1 : في تفاعل النشادر مع كلوريد الهيدروجين لانتاج ملح كلوريد الأمونيوم تتكون رابطة تناسقية بين ذرة النيتروجين في النشادر وذرة الهيدروجين في كلوريد الهيدروجين .
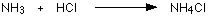
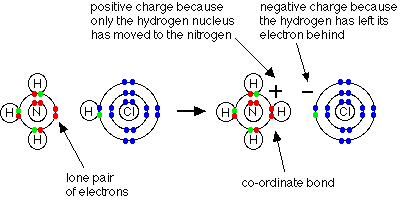
فالرابطة التناسقية تتكون بين ( ذرة مانحة ) تتكون عليها شحنة موجبة و ( ذرة مستقبلة ) تتكون عليها شحنة سالبة ويشار إلى الرابطة التناسقية عادةً بسهم يتجه من الذرة المانحة إلى الذرة المستقبلة .

وحقيقة ما حدث في التفاعل السابق هو ارتباط جزيء النشادر بالبروتون ليتكون أيون الأمونيوم .

مثال2 : عند إذابة غاز كلوريد الهيدروجين في الماء لتكوين حمض الكلور تتكون رابطة تناسقية بين ذرة الأكسجين في الماء وذرة الهيدروجين في كلوريد الهيدروجين .
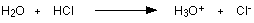
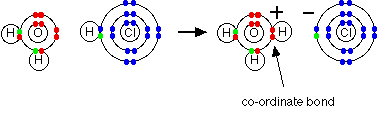
وهنا تكون ذرة الأكسجين هي الذرة المانحة وذرة الهيدروجين الذرة المستقبلة .
مثال 3 : في تفاعل النشادر مع ثالث فلوريد البورون تتكون رابطة تناسقية بين ذرة النيتروجين ( المانحة ) وذرة البورون ( المستقبلة ).

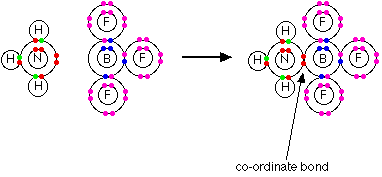
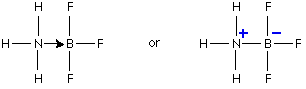
وتسمى المركبات الحاوية للراوبط التناسقية بالمركبات التناسقية ، والجدير بالذكر أن معظم العناصر الانتقالية ترتبط بروابط تناسقية وتكوّن هذا النوع من المركبات .
يتبع بقية الروابط
الأهداف التعليمية
يتوقع من الطالب في نهاية الدرس أن :
1- يعرّف الرابطة التساهمية التناسقية .
2- يميّز بين الرابطة التساهمية العادية والرابطة التساهمية التناسقية
3- يمثّل للرابطة التساهمية التناسقية .
4- يوضّح مفهوم الرابطة الهيدروجينية .
5- يمثّل للرابطة الهيدروجينية .
6- يوضح أثر الرابطة الهيدروجينية على درجات غليان وانصهار المواد .
7- يعلّل ارتفاع درجة غليان الماء مقارنةً بمركبات عناصر المجموعة السادسة مع الهيدروجين .
8- يشرح مفهوم الرابطة الفلزية .
9- يفسّر سبب توصيل الفلزات الجيد للحرارة والكهرباء .
10- يذكر ماهية روابط ( قوى ) فان درفال .
11- يمثّل لروابط فان درفال .
الرابطة التناسقية CO-ORDINATE (DATIVE COVALENT) BONDING
عبارة عن رابطة تساهمية تساهم فيها إحدى الذرتين بالزوج الالكتروني الرابط بينما يقتصر دور الذرة الأخرى على المساهمة بمجال فارغ .
مثال1 : في تفاعل النشادر مع كلوريد الهيدروجين لانتاج ملح كلوريد الأمونيوم تتكون رابطة تناسقية بين ذرة النيتروجين في النشادر وذرة الهيدروجين في كلوريد الهيدروجين .
فالرابطة التناسقية تتكون بين ( ذرة مانحة ) تتكون عليها شحنة موجبة و ( ذرة مستقبلة ) تتكون عليها شحنة سالبة ويشار إلى الرابطة التناسقية عادةً بسهم يتجه من الذرة المانحة إلى الذرة المستقبلة .

وحقيقة ما حدث في التفاعل السابق هو ارتباط جزيء النشادر بالبروتون ليتكون أيون الأمونيوم .

مثال2 : عند إذابة غاز كلوريد الهيدروجين في الماء لتكوين حمض الكلور تتكون رابطة تناسقية بين ذرة الأكسجين في الماء وذرة الهيدروجين في كلوريد الهيدروجين .
وهنا تكون ذرة الأكسجين هي الذرة المانحة وذرة الهيدروجين الذرة المستقبلة .
مثال 3 : في تفاعل النشادر مع ثالث فلوريد البورون تتكون رابطة تناسقية بين ذرة النيتروجين ( المانحة ) وذرة البورون ( المستقبلة ).

وتسمى المركبات الحاوية للراوبط التناسقية بالمركبات التناسقية ، والجدير بالذكر أن معظم العناصر الانتقالية ترتبط بروابط تناسقية وتكوّن هذا النوع من المركبات .
يتبع بقية الروابط




